
《医疗器械注册管理办法》(国家食品药品监督管理总局令第4号)第五条“第一类医疗器械实行备案管理……境内第一类医疗器械备案,备案人向设区的市级食品药品监督管理部门提交备案资料;进口第一类医疗器械备案,备案人向国家食品药品监督管理总局提交备案资料”;
服务项目:
1)确定产品是否属于第一类医疗器械;
2)必要时(仅适用产品不在现有第一类分类目录中),申请分类界定;
3)主导编制产品备案所需的申报资料;
4)整理、审核申报资料,并指导企业递交;
5)跟踪、修订(必要时)。
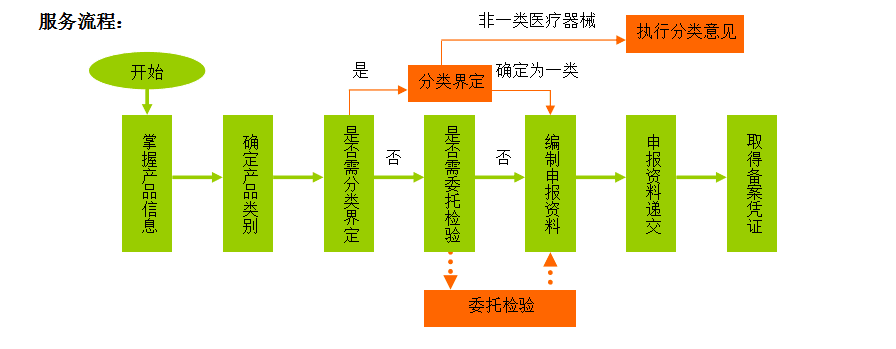
备注:
1、第一类医疗器械产品备案原则上向生产企业所在地设区的市级主管部门递交备案资料,但不排除各地因政策差异导致受理主体或申报资料存在差异;进口第一类医疗器械备案,向国家局提交备案资料,香港、澳门、台湾地区医疗器械的备案,参照进口医疗器械办理;
2、按现有法规,第一类有源(带电)医疗器械在产品备案前需取得EMC报告;针对企业无检测能力的检验项目,也应取得委托检验报告;与人体直接接触的器械还应按法规要求进行生物学评价;
3、常规情况下(无需分类以及检验的国产产品),产品备案总时长为2~4个工作日;
Copyright © 2019 杭州银河galaxy中国科技有限公司. All rights reserved